![]()
![]()
 特性
特性
密度:1.429kg/m3
大氣含量:21%
熔點:-222.80 °C
沸點:-182.97 °C
氧氣是提供生物進行呼吸作用的氣體,如果沒有氧氣的話,我們都沒有辦法呼吸了。除了呼吸之外,氧氣還能幫助物體燃燒、氧化,我們身邊許多重要的化學反應都和氧氣有關。
地球一開始是沒有氧氣的,一直到地球的海洋中出現了藍綠藻之後,進行光合作用才慢慢有了氧氣。事實上對於當時的地球來說,氧氣是一種太活潑而有害的氣體。甚至有一些物種因為氧氣的濃度越來越濃而滅絕。所以藍綠藻製造出來的氧氣對當時而言可以說是第一宗嚴重空氣污染造成破壞的案例。
 相關歷史
相關歷史
西方科學家第一位取得純氧並且對他的化學性質作研究的人叫做舍勒。但是因為捨勒相信錯誤的燃素說,所以沒有辦法獲得進一步的瞭解。當時對氧氣的性質研究貢獻最大的人是普利士力,他用放大鏡聚焦日光來加熱氧化汞得到純的汞和氧氣。他發現小老鼠在這種氣體中神志會特別清楚,存活時間也比較長。他自己也曾經親自嘗試,發現這種氣體呼吸起來特別輕快。他甚至稱呼這種氣體為【上等空氣】。
但是普利士力和舍勒一樣都因為篤信燃素說而無法獲得更進一步的成果。一直到拉瓦錫對許多物質針對燃燒的本質進行了嚴密的化學實驗才真正將氧的性質研究出來。
![]() 製備方式
製備方式
最早:英人卜利士力加熱紅色氧化汞製得。
現今工業: 1、分餾液態空氣。 2、電解水:在陽極得到較高純度的氧氣。
實驗室:
以雙氧水和二氧化錳接觸後,二氧化錳會催化雙氧水分解成水和氧氣。接著以排水集氣法蒐集氧氣。
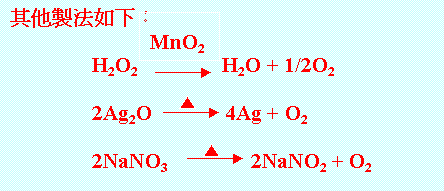
此外還可以用電解水的方式獲得氧氣。將水中加入少許的硫酸或氫氧化鈉後,以直流電通過水溶液,就會在正極的地方獲得氧氣。
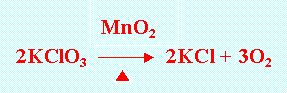
![]() 物理性質
物理性質
(1)無色、無臭、無味的氣體,略溶於水
(2)液態氧略呈藍色,沸點-182.96℃;固態氧呈灰黑色,熔點為-218.4℃。
![]() 化學性質
化學性質
氧氣是一種很好的助燃物,物體在純氧中會劇烈的燃燒。所以我們可以比較線香、鎂帶、硫粉和鋼絲絨在空氣中和純氧中燃燒的狀態來了解純氧的助燃性。
實際上燃燒是兩個物質產生了激烈的化學反應。通常是物質和氧氣之間的化學反應。反應速率若越大,反應就越激烈。氧氣濃度越高,反應速率就越大,所以我們就可以看到越激烈的燃燒反應。
化學性質活潑,除了惰性氣體,Au;Pt 等,大部份元素皆能與氧化合。如
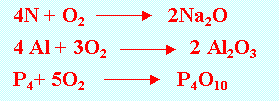
另外幾乎所有的有幾物皆可在氧中燃燒,如
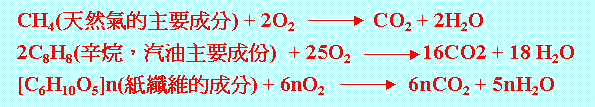
![]() 用途
用途
動植物呼吸、物質燃燒,煉鋼過程除碳,氫氣吹管及氧炔焰。
1.呼吸作用
2.助然,氫氧燄(氫氧吹管)或氧乙炔燄(氧炔吹管),產生高溫火燄,以焊接石英玻璃、鐵器及截斷鐵板等
3.高空、深海防毒救火攜帶氧氣筒
4.將氧經高壓低溫壓成液態,可與碳粉配合,用作開礦之炸藥
