![]()
![]()
 特性
特性
密度:1.98kg/m3
大氣含量:不固定
熔點:-57 °C
沸點:-78 °C
生物進行呼吸作用時,會放出二氧化碳。同時二氧化碳也是植物進行光合作用時的原料。二氧化碳的含量會隨著地區和時間而有變動。 晚上高於白天;工業區多於鄉村。二氧化碳對於地球的影響也很大,因為二氧化碳是
重要的溫室效應氣體。當二氧化碳濃度越來越高,溫室效應就越來越強,造成全球溫度的上昇。
 相關歷史
相關歷史
十八世紀的化學家用酸和石灰石混合,得到了二氧化碳氣體。發現二氧化碳會讓燃燒中的蠟燭熄滅。感覺上這種氣體似乎是固定在石灰石中,於是一開始科學家稱呼這種氣體叫做固定氣體。
這種氣體除了會讓蠟燭熄滅,也會讓麻雀和小老鼠窒息而死,和尋常的空氣大不相同。
後來拉瓦錫用放大鏡聚光燃燒在玻璃罩裡的鑽石得到這個固定氣體,證明這種氣體其實就是碳的氧化物。
![]() 製備方式
製備方式
用酸和碳酸鈣(石灰石、貝殼、大理石)反應,就可以產生二氧化碳。
![]()
用排水集氣法或向上排空氣法就可以得到二氧化碳。
![]() 物理性質
物理性質
1.二氧化碳為無色、無味、無臭的氣體。
2.商業上通常是將二氧化碳加壓液化(壓力需大於5.1atm),再裝於鋼筒中出售。 若使液態二氧化碳從鋼筒中流出汽化,吸收大量之熱,使其餘一部分溫度降 至-78.50C以下,則成固態的二氧化碳,俗稱乾冰(dry ice)。
3.乾冰在-78.50C之蒸氣壓為1atm,故在常壓下,不經液體直接氣化成氣體, 這種現象叫做昇華。
4.常壓下,二氧化碳在水中的溶解度比氮、氧大。
![]() 化學性質
化學性質
二氧化碳不可燃、不助燃。可以使澄清石灰水變的混濁。我們通常會使用澄清石灰水來檢驗二氧化碳。若氣體通過後使石灰水產生沉澱,我們就知道這個氣體裡面含有二氧化碳。
另外活性較大的金屬如鎂帶可以在二氧化碳中燃燒。鎂帶會奪走二氧化碳中的氧,將二氧化碳還原成碳元素。
在00C、1atm下,1升的水可以溶解二氧化碳1.713升,其中一部分與水作用, 生成碳酸:
![]()
二氧化碳不可燃、不自燃、不助燃,又比空氣重,可使可燃物和空氣中的氧 隔離,故二氧化碳可用做滅火劑。
二氧化碳的檢驗法: 二氧化碳通內入澄清的石灰水中可產生白色的碳酸鈣沉澱:
![]()
若二氧化碳通入過量時,生成的碳酸鈣沉澱即轉變為碳酸氫鈣而溶解,再將此 溶液加熱,則又折出碳酸鈣沉澱。
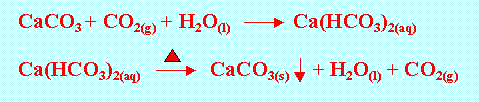
(此反應式可表示鐘乳石或石筍之成因)
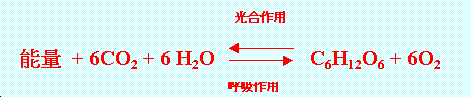
植物的光合作用可將二氧化碳和水轉變成葡萄糖:
![]() 用途
用途
1.二氧化碳可用做滅火劑,常用的滅火裝置有: (1).可用內盛高壓液態二氧化碳的鋼筒,將活塞打開,二氧化碳氣體噴出,即可 滅火。 (2).滅火器內有分隔開的濃硫酸與碳酸氫鈉(NaHCO3)溶液,若將滅火器倒持 令兩者混合反應,即可產生二氧化碳來滅火:
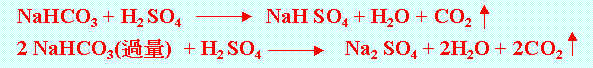
2.二氧化碳可供製作清涼可口的飲料: 例如沈水、可樂、香檳酒及啤酒,均為在高壓下溶入二氧化碳的氣體,故均 呈弱酸性。
3.乾冰(固態的二氧化碳)可用做冷卻劑: 例如乾冰與丙酮混合,可使溫度持保持在-780C。
4.乾冰可以製造煙幕: 因為乾冰沒有毒性且可以昇華,故在娛樂界的舞台表演,常用乾冰來製造煙 幕,增加場面的景觀。
